
Un panel federal de especialistas en cáncer, el pasado miércoles, por unanimidad, recomendó la aprobación de una droga experimental de Onyx Pharmaceuticals Inc. para los pacientes con cáncer de la sangre avanzado.

La FDA no está obligada a seguir el consejo del grupo, pero lo hace a menudo. La decisión final se espera para el 27 de julio.
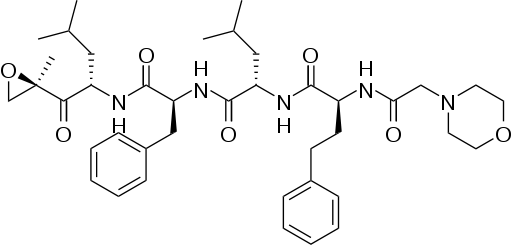
En los documentos publicados a principios de esta semana, científicos de la FDA expresaran su preocupación sobre la seguridad de carfilzomib, incluidos los efectos secundarios tóxicos sobre el corazón y los pulmones. También cuestionaron la eficacia del medicamento inyectable.
Onyx estudio el fármaco en 266 pacientes que ya habían sido tratados con dos fármacos contra el cáncer. Alrededor del 22 por ciento de los pacientes estudiados respondieron a la droga. En su informe, el panel de la FDA comentó que la tasa de respuesta fue tan baja que «no puede proporcionar una ventaja sobre los tratamientos disponibles.»
Sin embargo, los panelistas de la FDA dijeran que la droga podría ser un tratamiento importante para pacientes con pocas opciones. La FDA ha aprobado siete fármacos para el mieloma múltiple. Los médicos usan diferentes tratamientos dependiendo de la edad del paciente y la salud y la etapa de la enfermedad.
Más de 50.000 personas tienen mieloma múltiple en los EE.UU., y alrededor de 20.000 nuevos casos son diagnosticados cada año.