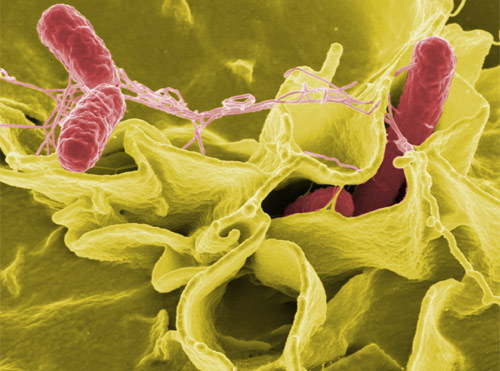

Los investigadores en el Centro de Genómica Estructural de Enfermedades Infecciosas (CSGID) y el Centro de Genómica Estructural de Seattle de Enfermedades Infecciosas (SSGCID) anunció hoy que alcanzó un hito significativo en la determinación de 1,000 estructuras de proteínas de organismos causantes de enfermedades infecciosas. El conocimiento obtenido de estas estructuras debe conducir a nuevas intervenciones para las enfermedades mortales causadas por estos patógenos.


Los investigadores de ambos centros de usar cristalografía de rayos X y resonancia magnética nuclear para examinar los detalles atómicos de proteínas a partir de más de 40 patógenos humanos, incluyendo a los responsables de la peste, el ántrax, la salmonelosis, el cólera, la tuberculosis (TB), la lepra, la disentería amebiana y la influenza. Las proteínas son seleccionados por su relevancia biomédica, así como los posibles beneficios terapéuticos y de diagnóstico, con una tercera parte son peticiones directas de la comunidad de investigación de enfermedades infecciosas.
«Estamos sentando las bases para el descubrimiento de fármacos», dice Anderson. «Determinación de estructuras de proteínas puede ayudar a los investigadores a encontrar blancos potenciales para nuevos medicamentos, enzimas esenciales, y los candidatos posibles vacunas.» Myler añade: «La importancia de este trabajo se destaca por los artículos 80 + científicos publicados por los dos centros, que también exhiben las nuevas metodologías desarrolladas por cada centro.
«Uno de los retos más importantes en la medicina hoy en día se lucha contra las bacterias que se han vuelto resistentes a los medicamentos. El Staphylococcus aureus resistente a meticilina, conocido comúnmente como el MRSA, es increíblemente difícil de tratar, ya que ha desarrollado una resistencia a los antibióticos, como penicilina y las cefalosporinas.
«Al determinar la estructura de las proteínas blanco de estos medicamentos, ahora podemos ver cómo los átomos están dispuestos en el espacio y la forma en que interactúan unos con otros», dice Anderson. «Entonces, los investigadores pueden determinar cómo la bacteria desarrolla resistencia y averiguar lo que al cambio en el medicamento para que las bacterias no lo reconocerá.» Dr. Lance Stewart, co-IP de la SSGCID, continúa, «El surgimiento de múltiples drogas cepas resistentes de Mycobacterium tuberculosis (TB-MDR), es también un importante problema de salud global, con los casos más recientes de tuberculosis emergente de la India siendo considerada ampliamente resistente a fármacos (XDR-TB). »
La Organización Mundial de la Salud (OMS) y otras autoridades mundiales de salud han pedido un esfuerzo concertado para identificar nuevos agentes terapéuticos para nuevos y mejores medicamentos para combatir la tuberculosis, sobre todo los medicamentos dirigidos a tratar las cepas resistentes a los medicamentos de la enfermedad. El SSGCID ha resuelto 22 estructuras de M. tuberculosis y un adicional de 126 objetivos estrechamente relacionados de otras especies de Mycobacterium, que causan enfermedades como la lepra, la úlcera de Buruli, y infecciones pulmonares en pacientes con SIDA. Estas estructuras ayudará en la comprensión de estas enfermedades mortales, así como proporcionar un plan para el desarrollo de nuevos fármacos.
Cuando los dos centros de genómica estructural originalmente recibió financiamiento de los NIH, su expectativa era resolver 750 estructuras, en conjunto, más de cinco años. Sin embargo, ambos centros han visto obligados a superar esta meta por la necesidad de que los datos estructurales de estos patógenos. Los avances en la tecnología y la eficiencia de los dos equipos les ha permitido superar con creces su objetivo inicial, incluso antes de la finalización del contrato de 5 años.
«Antes de tomar cuatro años para determinar una estructura», dice Anderson, «ahora podemos hacer alrededor de tres por semana.» Myler dice: «La interacción de nuestros centros con más de doscientos colaboradores científicos acelerará en gran medida el desarrollo de fármacos y la comprensión de la biología de estos organismos». Cada institución en los dos consorcios contribuye a diferentes aspectos de la tubería de alto rendimiento, que incluyen la selección de proteínas diana con la bioinformática, la clonación de los genes en bacterias para la producción de proteínas, purificación y cristalización, con los datos de difracción de rayos X recogidos a las 9 de haz diferente las líneas alrededor de los Estados Unidos y Canadá.
Después de las estructuras de las proteínas se resuelven, sus coordenadas están disponibles libremente para la comunidad de investigación por el depósito en el NIH-apoyada por Protein Data Bank. Las estructuras también se puede acceder a los sitios web y CSGID SSGCID. Los miembros de la comunidad científica interesada en los objetivos de la proteína de nominación para la determinación estructural puede completar un formulario de solicitud en la página web o SSGCID CSGID. Este servicio se ofrece de forma gratuita a la comunidad científica, y los dos centros también distribuir libremente los clones de expresión de proteínas a través de la Biodefensa financiado por los NIH y Repositorio de Infecciones Emergentes de Investigación de Recursos.
estructuras de proteínas en enfermedades