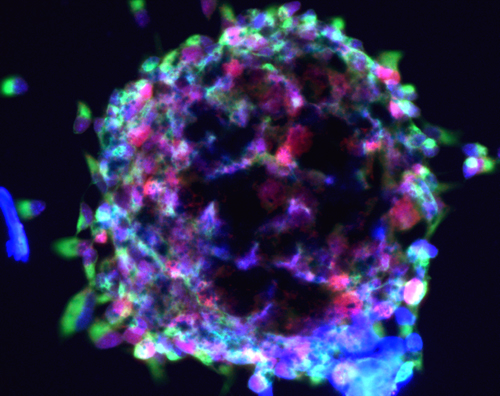

Investigadores de UCLA han descubierto un tipo de célula que es el «eslabón perdido» entre las células madre de médula ósea y de todas las células del sistema inmune humano, un hallazgo que dará lugar a una mayor comprensión de cómo funciona un sistema inmunológico saludable y cómo se produce la enfermedad puede conducir a la función inmune deficiente.

«Los pocos estudios con tejidos humanos han utilizado principalmente sangre del cordón umbilical, que no refleja el sistema inmune de la vida postnatal.» El equipo de investigación estaba «intrigado a encontrar esta célula de la médula ósea en particular, ya que abre un montón de posibilidades en cuanto a la comprensión de cómo se produce la inmunidad humana a partir de células madre durante toda la vida», dijo Crooks, profesor de patología y pediatría. Comprender el proceso de formación de la sangre normal en adultos humanos es un paso crucial en el esclarecimiento de lo que va mal en el proceso que resulta en leucemias o cánceres de la sangre.
El estudio aparece en 2 de septiembre en la edición de Nature Immunology. Antes de este estudio, los investigadores tenían una idea bastante buena de cómo encontrar y estudiar las células madre de la sangre de la médula ósea. Las células madre viva para siempre, se reproducen y dan lugar a todas las células de la sangre. En el proceso, las células madre se dividen y producen etapas intermedias de desarrollo llamada progenitores, que hacen que diversos linajes sanguíneos, tales como glóbulos rojos o plaquetas.
Crooks estaba más interesado en la creación de los progenitores que forman la totalidad del sistema inmune, que se compone de muchas células diferentes llamadas linfocitos, cada uno con una función especializada para combatir la infección.
«Al igual que las células madre, las células madre son también muy raros, así que antes de que podamos estudiar lo que necesitábamos para encontrar la aguja en el pajar». dijo Lisa Kohn, un miembro del Programa de Formación Científico Médico de la UCLA y primer autor en el papel. Trabajos anteriores habían encontrado un tipo bastante madura de linfocito progenitor con una capacidad limitada para diferenciarse, pero el nuevo trabajo describe un tipo más primitivo de progenitor preparados para producir todo el sistema inmunológico, dijo Kohn Una vez que el progenitor linfoide cebada había sido identificado, Crooks y su equipo estudiaron cómo la expresión de genes cambiado durante las primeras etapas de su producción a partir de células madre. «Los datos de expresión génica nos convenció de que había encontrado una etapa única de desarrollo en el sistema inmunológico. Había un conjunto de genes que las linfoides cebados con acciones células con las células madre de la médula ósea y una expresión de genes único en su cuenta una vez que se activa.
Estos datos nos proporcionan una comprensión de qué genes son importantes en la creación de todas las células del sistema inmune «, dijo Crooks. «La información nos permitiría manipular la médula ósea para ayudar a crear un sistema inmune más fuerte.» Como médico trasplante de médula ósea que trata a los niños con deficiencia de muchas enfermedades como la leucemia y el inmunológico, Crooks está muy interesado en cómo el sistema inmunológico está hecho y, más específicamente, las nuevas formas que puede haber para acelerar ese proceso a lo largo de sus pacientes, cuya sistema inmune son eliminados antes del trasplante.
«La identificación de un progenitor en la médula ósea humana preparada para la diferenciación linfoide completo ahora permitirá la delimitación de la regulación molecular de las primeras etapas de compromiso linfático en la hematopoyesis humana», señala el estudio. «También permitirá la comprensión de cómo estos procesos se ven afectados durante la hematopoyesis anormal en estados de enfermedad.»
las celulas